Prof. Dr. Ayhan DİNÇKAN
Karaciğer
Transplantasyonunda
İmmünsüpresyon
En etkin tedavi yöntemi!
Karaciğer Transplantasyonunda İmmünsüpresyon
Son dönem organ yetmezliğinin en etkin tedavi yöntemi olarak kabul edilen organ naklinden sonra kullanılan immunsüpresif tedavinin amacı; nakil edilen allograftın akut reddinin önlenmesi, daha uzun graft ve hasta sağkalımı ile hayat kalitesinin iyileştirilmesidir. Ancak bu ilaçların hasta ve graftı korumanın yanında olası infeksiyon, malignite ve diğer klinik yan etkilerinden kaçınmak için gerekli tedbirler alınmalıdır. İmmunsüpresif ilaçlar iki tarafı keskin bıçaktır. Bir yandan grafta karşı hücresel immuniteyi inhibe ederken, diğer yandan vücudun savunma sistemini zayıflatarak hastaları infeksiyonlara yatkın hale getirir. Ayrıca ilaçların çoğu karaciğerde sitokrom P450 enzim sistemi ile metabolize olur, bu nedenle de birçok ilaçla etkileşime girer. İmmunsüpresyon etkisinin güçlü olması, etkinliğinin kolay takip edilmesi ve ucuz olması yanında yan etkilerinin olabildiğince az olması günümüzde iyi bir immunsüpresif ilaçta aranan özelliklerdir.

1960’lı yıllarda total vücut radyasyonundan sonra ilk immunsüpresif ilaç olarak azatiyoprin kortikosteroidler ile birlikte böbrek naklinde kullanılmıştır. İlk başarılı karaciğer nakli 1967 yılında T. Starzl tarafından yapıldığında da benzer ilaçlar kullanılmıştır. 1970’lerin ortalarında antitimosit globulin (ATG) ve antilenfosit globulin (ALG) gibi poliklonal antikor preparatları kullanılmıştır. 1980’in başında siklosporinin R. Calne tarafından kullanımı ile organ naklinde büyük bir devrim gerçekleşmiş ve siklosporinli protokoller bir yıllık graft sağkalım oranlarını %80’lerin üzerine çıkartmıştır. 1990’lı yıllarda immunsüpresyon protokollerine iki önemli ilaç eklenmiştir. Önce takrolimus karaciğer naklinde ardından diğer solid organ nakillerinde siklosporine benzer bir başarı sağlamıştır. Bir süre sonra, siklosporin ya da takrolimusla birlikte kullanıldığında, akut rejeksiyon sıklığını azaltma açısından mikofenolat mofetilin (MMF), azatiyoprinden (AZA) daha etkin olduğu gösterilmiştir. 2000’e doğru immunsüpresif ilaçlara sirolimus ve son olarak everolimus eklenmiştir. İmmunsüpresif tedavi olanaklarını geliştirmek ve genişletmek için yeni ilaç çalışmaları devam etmektedir.
İmmunsüpresif İlaçlar
Kalsinörin İnhibitörleri (Cni)
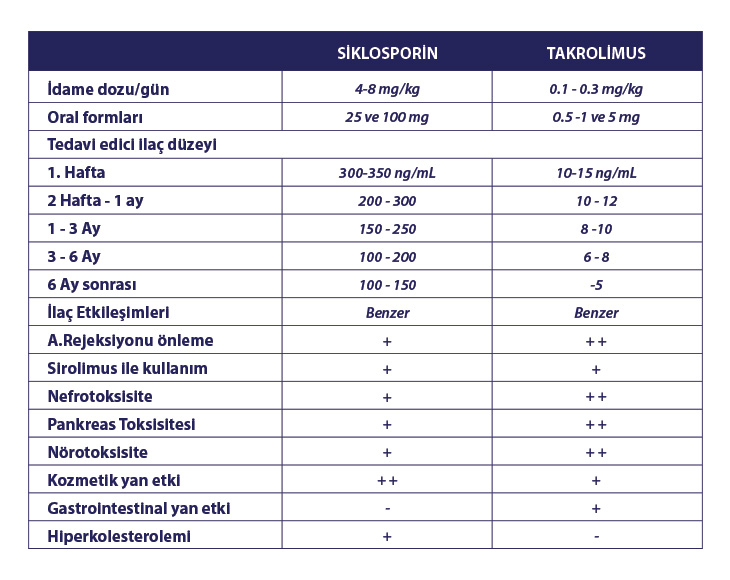
Solid organ nakillerindeki immunsüpresif tedavinin temel direğini CNİ olarak bilinen siklosporin ve takrolimus oluşturmaktadır. Siklosporin mantar kaynaklı küçük siklik bir polipepdit iken, takrolimus (FK-506) ise Streptomyces Tsukabaensis’ten elde edilen makrolid yapılı bir antibiyotiktir. Biyokimyasal olarak farklı olmalarına rağmen bu iki ilaç etki mekanizmaları, klinik ve yan etkileri açısından birbirlerine yakındırlar (Tablo-1). Takrolimus ve siklosporin karaciğer naklinde benzer hasta ve graft sağkalımına sahip olup, takrolimusun özellikle kronik rejeksiyonda daha faydalı olduğu düşünülmektedir.
Siklosporin:
Yağda eriyen orijinal formülü olan Sandimmune, yerini büyük ölçüde mikro emülsiyon formüllü neorale bırakmıştır. Sandimmunun gastrointestinal sistemden emilimi safraya bağımlı olduğundan, diyabetik gastroparezisi, ishali, safra diversiyonu, kolestazı ve malabsorpsiyonu olan hastalarda güvenilir olmayabilir. Bunun yanında mikroemülsiyon şekli olan neoral; gastrointestinal sistemden daha iyi emilir ve emilimi safraya daha az bağımlıdır. Dolayısı ile neoralin biyoyararlanımı, sandimmundan daha iyi olup farmakokinetiği daha az değişkenlik göstererek, sistemik yayılımı ile çukur düzeyi (trough level) arasında daha iyi bir uyum vardır.
Neoral formunun 25 ve 100 mg’lık kapsülleri 50 ve 100 mg/ml solüsyonları vardır. İlaçlar aç karnına alınmalı ancak mide iritasyonunu azaltmak için yiyeceklerle birlikte de alınabilir. Hastanın durumuna göre (ventilatörden ayrılma ve böbrek fonksiyonlarında düzelme vb) siklosporin 3-5 mg/kg şekilde günde iki dozda başlanabilir.
Takrolimus:
Gastrointestinal sistemden emilimi, safra tuzlarına bağımlı değildir. İnce bağırsaktan ilaç emilimi, aynı bireyde ve bireyler arasında oldukça büyük değişkenlik göstermekle beraber, oral kullanımda biyoyararlınımı % 25 civarındadır. Katı gıdaların mideden boşalmasının takrolimus kullananlarda, siklosporin kullananlara oranla daha hızlı olması nedeni ile gastrik motilite bozukluğu olanlarda takrolimus kullanımı yararlı olabilir. Klinik kullanımda takrolimusun 0,5-1 ve 5 mg’lık kapsül ve 5 mg/ml IV infüzyon formları vardır. Takrolimusun terapötik etkinliği serum çukur düzeyi ile takip edilir. Greyfurt suyu serum ilaç düzeyini arttırdığı için takrolimus ile birlikte kullanılmamalıdır. Hastanın durumuna göre (ventilatörden ayrılma ve böbrek fonksiyonlarında düzelme vb) ilaç 0,15 mg/kg şekilde günde iki dozda başlanabilir.
Takrolimusun uzun salınımlı formunun (günde tek doz) Avrupa Birliği ülkelerinde kullanılmasına onay verilmiştir. Faz 2 ve 3 çalışmaları böbrek, karaciğer, kalp nakillerinde yapılmış ve günlük iki doz alınan formu kadar güvenli ve etkin olduğu gösterilmiştir. Tek doz formunun karaciğer naklinde başlangıç dozu olarak 0,1-0,2 mg/kg olarak önerilmektedir.
Tablo 1
Etki Mekanizması: Bu ilaçlar kendilerine özgü sitoplazmik reseptör proteinleri olan siklosporin için siklofilin, takrolimus için takrolimus bağlayıcı protein (FKBP) ile bileşik oluştururlar. Bu bileşikler, normalde düzenleyici çekirdek proteinleri üzerine defosforile etkisi yaparak çekirdek zarından geçmelerini kolaylaştıran kalsinörine bağlanırlar. Kalsinörin inhibisyonu ile T hücre aktivasyonunu artıran kritik sitokin genlerinin (IL-2, IL-4, IFN-gama, TNF-alfa) ekspresyonu bozulmaktadır. Sonuç olarak, kalsinörin inhibisyonu ile sitokin üretiminde ve lenfosit proliferasyonunda sayısal bir azalma ortaya çıkmaktadır. Kalsinörin inhibisyonuna takrolimusun etkisi siklosporinden 10-100 kat daha fazladır. Takrolimusun hepatotropik özelliği (granülosit-makrofaj koloni stimülan faktörün transkripsiyonu ile) siklosporin tarafından gösterilememektedir. Bu doku spesifik dağılım takrolimus tedavisi altında görülen düşük allograft rejeksiyon oranı ile kısmen ilişkilidir. Buna karşın siklosporinin HCV RNA sentezini engelleme etkisi ile HCV replikasyonuna potent inhibisyon etkisi gösterirken, takrolimusun HCV RNA düzeylerine etkisi yoktur. Dolayısı ile HCV’li karaciğer nakli hastalarında graft sağkalımı siklosporin tabanlı immunsüpresyon protokolleri ile daha iyi olabilir.
Metabolizma: Her iki ilacında yarı ömrü yaklaşık 8 saattir. İlaçlar gastrointestinal ve karaciğer mikrozomal enzim sisteminde bulunan sitokrom P450 III A (CYP3A) tarafından metabolize edilerek metabolitleri ortaya çıkar. CYP3A gen ekspresyonundaki heterojenite, ilaç kinetiğinin hastalar arasındaki büyük değişkenliğinden sorumludur. İlaçlar karaciğerden metabolize olduktan sonra küçük bir kısmı böbrek yolu ile olmak üzere genellikle safra yolu ile atılırlar. Bu nedenle böbrek fonksiyon bozukluklarında ilaç dozunun ayarlanmasına gerek yoktur.
Aynı hastada ve değişik hastalar arasında büyük farmakokinetik değişkenlikler nedeni ile siklosporin ve takrolimus düzeylerinin ölçülmesi ve izlenmesi gerekir. Ancak bu şekilde organ nakli hastasında tedavisi rasyonel olarak düzenlenebilir. Her zaman tutarlı olmasa da, bu ilaçların kan düzeyleri ile rejeksiyon atakları ve toksisiteleri arasında ilişki olduğu bilinmektedir. İlaçların kan düzeyi izlemi için ilacın organizmada dağılımını daha iyi yansıtan ve toksik etkileri ile daha uyumlu bulunduğu için, siklosporin ve takrolimus tepe düzeyi (peak level) yerine çukur düzeyi (trough level) (ölçüm için örnek bir sonraki doz verilmeden hemen önce alınmalı) esas alınmaktadır. Ancak son yıllarda neoralin izleminde, tepe düzeyinin (doz verildikten 2 saat sonra; C2) ilacın organizmada dağılımını çukur düzeyinden daha iyi yansıttığı bildirilmektedir.
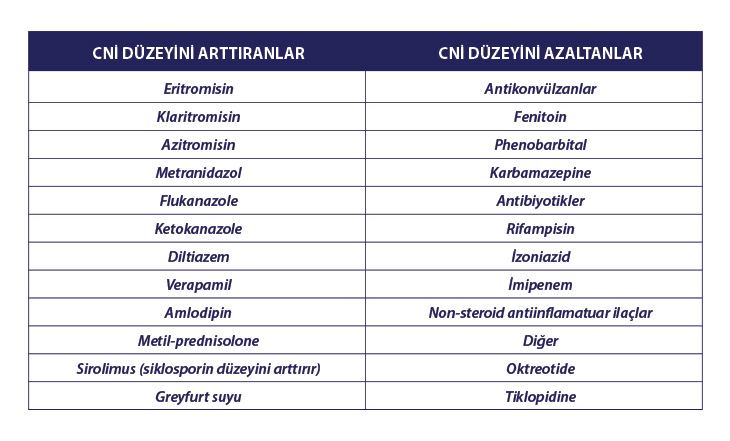
İlaç Etkileşimleri: Hem siklosporin hem takrolimusun sık kullanılan pek çok ilaçla potansiyel etkileşimi söz konusudur. Potansiyel olarak riskli ilaçlar dikkatli kullanılmalı, tedaviye başlamadan önce hastanın siklosporin veya takrolimus kullanımı sorgulanmalıdır.
Tablo 2
Kalsinörin İnhibitörleri ile etkileşime giren ilaçlar
Yan Etkiler:Nefrotoksisite, her iki kalsinörin inhibitörünün en önemli yan etkisidir. Nefrotoksisite, böbrekte çeşitli morfolojik ve fonksiyonel değişikliklerden oluşan çeşitli sendromlar şeklinde ortaya çıkabilmektedir. Afferent arteriyollerde doza bağımlı olarak reversible vazokontriksiyon ve sonuçta, böbrek kan akımında ve glomerüler filtrasyon hızında azalmaya neden olarak akut nefrotoksisiteye yol açarlar. Bu tablo fonksiyonel prerenal azotemiye benzer.
Bozulmuş sodyum atılımı, CNİ’nin böbrekteki vazokonstriktif etkisinin sonucudur. Uzun süreli siklosporin tedavisi alan hastalar, sodyum ve su retansiyonu ve hipertansiyona eğilimlidir. Büyük olasılıkla siklosporine göre daha az periferik vazokostriksiyon yapması nedeni ile takrolimus alan hastalarda hipertansiyon daha az oranda gelişir. Böbrek fonksiyonu iyi olduğu sürece yaşamı nadiren tehdit eden hiperpotasemi sık görülür ve bazen tedavi gerektirir.
Hepatik disfonksiyon takrolimus kullananlarda nadir, siklosporin alanların %50’sinde görülebilen ancak doz bağımlı, kendi kendini sınırlayan, orta düzeyde serum transaminaz yükselmesi ve hafif hiperbilirubinemi ile seyredebilen bir durumdur. Hiperbilirubinemi hepatosellüler hasardan çok safra atılımındaki bozukluğun yansıması olarak kabul edilmiştir.
Siklosporin kullananların çoğunda değişik derecelerde görülen hipertirikozis, özellikle esmer kadınlarda daha belirgindir. Siklosporin alan hastalarda ciddi düzeyde jinjival hiperplazi gelişebilir. Diş temizliğinin kötü olması ile birlikte kullanılan kalsiyum kanal blokerleri jinjival hiperplaziyi ağırlaştırabilir. Siklosporin, prolaktin düzeyini artırabildiğinden erkeklerde jinekomasti, kadınlarda ise meme hipertrofisi oluşturabilir. Takrolimus kullananlarda ise alopesi gelişebilmekle birlikte kozmetik yan etkileri daha az belirgindir. Siklosporinin kozmetik yan etkileri tıbbi anlamda ciddi olmasa da, özellikle gençler ve kadınlarda tedavi uyumsuzluğu yaratabilir. Kortikosteroidlerin birlikte kullanımı siklosporinin kozmetik yan etkilerini artırmakla birlikte bu tür sonuçlar zamanla azalma eğilimi gösterebilmektedir.
Hiperlipidemi siklosporin kullanan organ alıcılarında görülen yan etkilerden biridir. Bu etkinin mekanizması, düşük dansiteli lipoproteinlerin karaciğer tarafından yapılan geri bildirim kontrolünün anormalliği, safra asiti sentezindeki değişim veya düşük dansiteli lipoprotein reseptörlerinin siklosporin tarafından işgali ile ilgili olabilir. Bu etki takrolimus kullananlarda daha düşüktür ve siklosporin tedavisinden takrolimusa geçildiğinde lipid düzeylerinde düzelme olabilmektedir.
Takrolimus ile daha belirgin olmak üzere, her iki kalsinörin inhibitörü pankreas adacıkları için toksik olup glukoz intoleransına neden olarak New-onset diabetes mellitus (NODAT) gelişebilir. Nakil sonrası görülme sıklığı zamanla azalır, birinci yıl içinde yeni başlayan ve insülin gerektiren glukoz intoleransı gelişen olguların oranı, takrolimus alanlarda %25 iken, siklosporin alanlarda %5 düzeyindedir. NODAT riski hepatit C infeksiyonlu hastalarda daha da yüksektir. Takrolimus kullananlarda daha belirgin olmak üzere kalsinörin inhibitörü kullanan hastalarda çeşitli nörolojik yan etkiler gözlenmektedir. Doz bağımlı olabilen kaba tremor, disestezi, baş ağrısı ve uykusuzluk sık görülen yakınmalardır.
Azatiyoprin Ve Mikofenolat Mofetil
Azatiyoprin (AZA), 6-merkaptopurin’in imidazol türevi olan bir antimetabolittir. AZA hücresel DNA ile birleşerek pürin nükleotid sentezini inhibe eden, RNA sentez ve metabolizmasını bozan bir pürin analoğudur. Organ naklinde son 30 yıldır kullanılmaktadır. Siklosporinin klinik kullanıma girmesiyle birlikte AZA’nın rolü azalmıştır. MMF’in devreye girmesiyle de birçok programda kullanımına son verilmiştir.
Aktif metaboliti mikofenolik asid (MPA) olan bir penisiliyum türünün fermentasyon ürünü olan MMF, 1995 yılından beri organ nakillerinde kullanılmaya başlamıştır. MPA, İnosin Monofosfat Dehidrogenaz (İMPDH) enziminin reversible inhibitörüdür. İMPDH, pürinlerin de-nova sentez hızını ayarlayan ve inozinden guanozin nükleotidlerin oluşmasını katalize eden kritik bir enzimdir. Lenfositler de-nova pürin sentezine, guaninden guanozin nükleotidlerin üretildiği kurtulma yolağına sahip olan diğer hücrelerden daha fazla bağımlı görünmektedir; guanozin nükleotidlerin MPA tarafından tüketilmesi, T ve B lenfositler üzerine göreceli seçiciliği olan antiproliferatif etki yapmaktadır. Solid organ nakillerinin idame immunsüpresyon tedavisinde kullanılmaktadır. Oral yoldan verilen MMF, gastro-intestinal sistemden hızla emilir, kanda albümine yüksek oranda bağlı olarak taşınır, karaciğerde glukuronil transferaz enzim sistemi ile MPA’e hidrolize edildikten sonra böbrek yolu ile atılır. MMF’in biri enterik kaplı (EC, enteric coating) olmak üzere iki oral formu vardır. EC formu midede yani asidik ortamda salınmaz, nötral ph’da yani intestinal sistemde salınır. Dolayısı ile EC formunun daha az gastrointestinal yan etkilere sahip olduğuna inanılır. Hastalar ilacı emilimde yaşanacak değişikliklerden dolayı aç karnına kullanmalıdır. Klinik kullanım için MMF’ in 250 ve 500 mg.lık, EC formunun 180 ve 360 mg’lık kapsülleri vardır. Standart MMF dozu 1-2 g/gün, EC formu ise 720-1440g/gün arasındadır. MMF için serum ilaç düzeyi takibi genellikle gerekli değildir. CNİ ilaçlarla birlikte kullanılır, ilk bir hafta içinde genellikle 1-2gr/ gün başlanır ve klinik deneyimlere göre değişiklik göstermekle birlikte genellikle ilk 3 ay içinde kullanıldıktan sonra kademeli olarak kesilebilir. Karaciğer naklinde MMF kullanım endikasyonları; steroidin daha hızlı azaltılması, CNI toksisitesi, steroid dirençli rejeksiyon tedavisi ve kronik rejeksiyon olarak ön plana çıkmaktadır.
Oral ülserasyon, iştahsızlık, bulantı-kusma, özofajit, gastrit, diyare ve kolonik ülserler gibi gastrointestinal yan etkileri vardır. Myelosüpresyon (lökopeni, anemi, trombositopeni) ve artmış infeksiyonlar (özellikle CMV, tüberküloz, menenjit), malignite (özellikle deri kanserleri ve lenfoma), pankreatit, dispne, interstisyel akciğer hastalığı diğer önemli yan etkileridir. Oportinistik infeksiyonlar yüksek doz MMF alan hastalarda daha yaygındır. Çok nadir olarak progresif multifokal lökoensefalopati gibi ciddi nörolojik yan etkilerde bildirilmektedir. MMF potansiyel olarak teratojenik bir ilaçtır dolayısı ile gebelik ihtimali durumlarında dikkatli olunmalıdır.
CYP3A enzim sistemi kanalı ile metabolize olmadığından, CNİ’inde görülen pek çok ilaç etkileşimi, MMF kullanımında görülmeyebilir. MMF ve AZA hematolojik toksisitelerinin birbirlerine eklenmesi nedeniyle eşzamanlı kullanılması sakıncalıdır. MMF ile takrolimus arasında farmakokinetik etkileşimin olması nedeni ile doz ayarlaması iyi yapılmalı, yoksa başta gastrointestinal yan etkiler olmak üzere toksik etkiler ortaya çıkabilir.
m-Tor (Mammalian Target Of Rapamycine) İnhibitörleri
m-TOR hemapoetik ve non-hemapoetik hücrelerde; hücre büyümesi, proliferasyonu, motilitesi, sağkalımı, protein sentezi ve transkripsiyonunu regüle eden bir serine/threonine protein kinazdır ve hücre döngüsünü kontrol edici etkileri vardır. m-TOR inhibisyonu ise hücre içindeki bu kinaz reseptörlerine bağlanarak, ribozomlar tarafından yeni protein sentezini baskılayıp hücre çoğalmasını engelleyerek immunsüpresif etkilerini gösterir. Bu grupta 1999 yılında klinik kullanıma sunulan sirolimus ile everolimus olmak üzere 2 temel ilaç vardır. Her iki ilaçta solid organ nakillerinin idame tedavisinde diğer immunsüpresif ilaçlarla kombinasyon şeklinde kullanılır.
Sirolimus:
Takrolimus ile yapısal benzerliği olan makrolid antibiyotiktir. CNİ’den farklı bir mekanizma ile immünsüpresyon oluşturur. CNİ gibi sirolimusda sitoplazmada bağlayıcı proteine bağlanır (bu protein takrolimusun bağlandığı proteinin aynıdır; FKBP). Sonuçta, sirolimus-FKBP bileşimi, kalsineurini engellemez ancak TOR (Target of Rapamycin) olarak bilinen proteine bağlanır. Anahtar öneminde düzenleyici bir kinaz olan TOR’un inhibisyonu, sitokin bağımlı hücresel proliferasyonu hücre bölünme siklusunu G1-S fazında yavaşlatmaktadır. Sirolimus, büyük oranda karaciğerde hem CYP3A, hem de n-glikoprotein kanalı ile metabolize edildikten sonra safra yolu ile atılır. Böbreklerden atılımı çok düşük düzeyde olduğundan böbrek fonksiyon bozukluklarında doz ayarlaması gerekmediği halde, karaciğeri bozuk olanlarda doz ayarlaması gerekmektedir.
Klinik kullanımı için 1 mg’lık tabletleri olup, 5-10 mg/gün yükleme dozunu takiben 1-5 mg/gün dozunda verilebilir. İlacın hedef çukur düzeyi 5-10 ng/dl arasındadır. CNI ile birlikte kullanıldığında hedef düzey daha da azaltılabilir. CNİ ve/veya antimetabolit ilaçların kullanılamadığı durumlarda tercih edilebilir. Ortalama 60 saat gibi uzun yarı ömre sahip olduğundan dolayı günde tek doz alınmakta ve kan düzeyi doz uyarlaması yapıldıktan birkaç gün sonra ölçülmelidir. Sirolimus, kalsiyum kanal blokerleri, antifungal ajanlar, antikonvülzan ve antitüberkülöz ajanlarla etkileşime girebilir.
Sirolimus hiperkolesterolemi ve hiperlipidemiye neden olmaktadır hastaların çoğu statin tedavisine iyi yanıt verirler. Sirolimus kullananlarda karaciğer enzim düzeylerinde artış görülebilir. İlaç ayrıca hiperkalemi, hipomagnezemi gibi elektrolit imbalansı yanında trombositopeni daha sık olmak üzere, lökopeni ve anemiye de neden olabilir. Sirolimus yapısal olarak takrolimusa benzemekle beraber, belki de farklı bir etki mekanizması nedeniyle nefrotoksik etkiye sahip değildir. Dolayısı ile hepatorenal sendrom veya böbrek fonksiyonları bozuk hastalarda CNİ’ne alternatif olabilirler. Karaciğer nakli hastalarında sirolimus kullanımındaki en büyük risk; sebebi net açıklanamayan hepatik arter trombozudur. Bu riski azaltmak için genellikle karaciğer naklinden 4-6 hafta sonra immunsüpresif protokollerde yer alması önerilmektedir. İlacın geç dönemde başlanmasının diğer bir nedeni antiproliferatif etkisi ile yüksek dozlarda yara iyileşmesini bozabilmesi ve yara ayrışmasına neden olabilmesidir. Sirolimusun vasküler endotelial growth faktörün ekspresyonunu azaltmakta ve bu etkisi ile antineoplastik etkisinin olduğuna inanılmaktadır. Dolayısı ile nakil endikasyonu HCC olan hastalarda rekürrensi azaltmak için tercih edilebilir. Sirolimus monoterapi postoperatif erken dönem rejeksiyon kontrolünde yeterli değildir. Bu nedenle sirolimusun rejeksiyon engellemesinde düşük doz CNİ ilaçlarla kombine edilmesi tavsiye edilir.
Everolimus:
Sirolimusa benzer etki ve yan etkiye sahip diğer bir m-TOR inhibitörü immunsüpresif ilaçtır. IL-2 ve IL-15 aracılı B ve T lenfositleriyle birlikte vasküler düz kas hücrelerinin proliferasyonunu inhibe eder. 0,25-0,75 mg’lık tabletleri olan ve çentik düzeyi 8-12 ng/ml hedef alınan ilaç sirolimustan farklı olarak günde iki doz şeklinde kullanılır. Yarı ömrünün 28-35 saat olmasına rağmen sabit kan düzeyine genelde 4-5 günde ulaşmasından dolayı kısa aralıklarla ilaç dozu değiştirilmemelidir. Hedef düzey özellikle CNİ’leriyle birlikte kullanıldığında 3-8 ng/ml’ye indirilebilir ve sirolimustan farklı olarak yükleme dozu gerekmemektedir. %80’i gaita %5’i idrarla atılır. Hafif veya orta şiddette karaciğer bozukluğu olanlarda; bilirubin >2mg/dl, albümin <3,5 gr/dl, INR>1,3 parametrelerinden en az ikisi varsa doz yarıya indirilirken, ciddi karaciğer yetmezliğinde kullanımıyla ilgili bilgi yoktur. Erkeklerde fertilite üzerine olumsuz etkilerinin yanında kadınlarda transplasental geçişle konjenital anomalilere neden olabilir. Myelosüpresyon, ishal, bulantı, hiperlipidemi, hipertansiyon, infeksiyon ve interstisyel pnömoni gibi yan etkileri vardır. Karaciğer nakillerindeki risk ve kullanım endikasyonları sirolimusta olduğu gibidir.
Kortikosteroidler
Kortikosteroidler, ilk kullanılan immunsüpresyon ilaçlardan olup, organ naklinin temel taşlarından birisidir ancak yan etkilerinin fazlalığı kullanımını sınırlandırmaktadır. Kortikosteroidler karaciğer naklinde indüksiyon tedavisinde ve akut rejeksiyon tedavisinde anahtar role sahiptir. Ancak uzun dönem yan etkileri nedeni ile erken kesilmesi hatta çoğu karaciğer naklindeki gibi tamamen kesilmesi söz konusudur.
İndüksiyon tedavisine intraoperatif 20 mg/kg IV metil-prednisolone ile başlanır. Birinci gün 3 mg/kg, devamında her gün 0,5 mg/kg azaltılarak 7. günde 0,5 mg/kg dozuna ulaşılır. İdame steroid tedavisi günlük, sabit, düşük dozlarda veya gün aşırı olmak üzere azaltılarak genellikle 3-6 ay içinde kesilmektedir. Bazı merkezler HCC ve HCV (viral yükü arttırıp, erken HCV reaktivasyon riski) durumunda steroid tedavisini 3 ay gibi erken bir sürede kesebilmektedirler. Ayrıca akut rejeksiyon tedavisinde de yüksek dozlarda (15-20 mg/kg) birkaç gün kullanılabilir. Ancak rejeksiyon tedavisinde steroidlerin kullanımı hastada HCV olup olmadığına bağlıdır çünkü HCV infekte hastalarda steroid kullanımı rekürrens oranını arttırabilmektedir.
Kortikosteroidlerin vücuttaki yaygın etkileri, hücre sitoplazmasında bulunan glikokortikoid reseptörleri aracılığı ile oluşmaktadır. Kortikosteroidlerin immünosüpresif etkileri basitçe; makrofajlarda interlökin (IL)-1 ve IL-6 üretimini baskılarken, T-hücre aktivasyonunun tüm evrelerini baskılayarak geniş ve non-spesifik bir etki sağlamasıdır. Aynı zamanda prostoglandin ve lökotrien salgısını inhibe ederken, histamin-bradikinin salınımını azaltıp lizozomal membranı stabilize ederek anti-inflamatuvar etkileri de mevcuttur.
Kortikosteroidlerin yan etkileri aslında hedef dokulardaki immünosüpresif, anti-inflamatuvar ve hormonal etkilerin sonucudur. En önemli yan etkileri kozmetik değişiklikler, sıvı retansiyonu, büyüme bozuklukları, cushing hastalığı, peptik ülser, pankreatit, osteoporoz, aseptik femur başı nekrozu, yara iyileşmesinin bozulması, infeksiyon tedavisine direnç, katarakt, hiperlipidemi, glukoz intoleransı-diyabet ve psikopatolojik etkilerdir. Günümüz ilaç kombinasyonlarında daha az kortikosteroid kullanımının öğrenilmesi sonucunda hastalarda morbidite ve mortalite oranları düşmüştür. Karaciğer nakillerinde 6. aydan sonra kesilmesi önerilen steroidlerin özellikle otoimmun hepatit ve sklerozan kolanjit gibi immunolojik temele dayalı son dönem karaciğer hastalığı gelişen hastalarda devam edilmesi başarı şansını arttırmaktadır. Sonuç olarak steroidlerin kullanımı merkezler arasında büyük oranda değişiklik gösterir.
Antikor Tedavileri
Poliklonal antikorlar, atların veya tavşanların, insan lenfoid dokuları ile immünize edildikten sonra oluşan immün serumdan elde edilmektedir. 1970’li yıllardan bu yana klinik organ naklinde çeşitli poliklonal kaynaklı antikorlar kullanılmaktadır. Halen klinikte yaygın olarak kullanılan poliklonal kaynaklı antikorlar Antitimosit Globulin (ATG) ve Timoglobulindir. Humanize anti-Tac monoklonal preparatları olan daklizumab ve basiliksimab ise 1998 yılında klinikte kullanıma sunulmuştur. Poliklonal antikorlar sürekli immunsüpresyon değil ancak immunsüpresif tedaviye başlarken (indüksiyon) ve steroide yanıt vermeyen akut rejeksiyonun tedavisinde kullanılabilirler.
Poliklonal Antikorlar (ATG ve Timoglobulin):
ATG insan lenfoid materyali ile atların, timoglobulin ise tavşanların immünizasyonu ile üretilmektedir. Poliklonal kaynaklı antikor uygulamasından sonra periferik kan lenfositleri azalmaktadır. Lenfositler ve özellikle de T-lenfositlerinin yüzey antijenleri antikor tarafından maskelenebilmekte, hücreler ya eritilerek yok edilmekte veya retikülo-endotelyal sistem aracılığı ile dolaşımdan temizlenmektedir. Timogulobulin uygulamasından sonra bazen uzun süreli lenfopeni oluşabilmekte ve CD4+ T-hücre alt grubu yıllarca baskılanmış kalabilmektedir. ATG karaciğer naklinin ilk uygulanan immunsüpresif ilaçlarından biridir ve rutin olarak AZA ve steroidlerle birlikte indüksiyon tedavisinde kullanılmıştır. Günümüzde hala allograft rejeksiyonunda oldukça potent bir immunsüpresyon olup, indüksiyon tedavisi ve steroide dirençli rejeksiyon tedavisinde etkin olarak kullanılmakta ve başarılı sonuçlar alınmaktadır. ATG 1-2,5mg/kg ve timoglobulin 1,5 mg/kg. dozlarda kullanılmaktadır. Her iki ilacın da tavsiye edilen uygulama süresi 7-14 gündür.
Alerjik reaksiyonlardan sakınmak için, poliklonal antikor uygulamasından 30 dakika önce, hastaya 30 mg metil-prednisolon ve antihistaminik ile premedikasyon yapılmalıdır. Ateşin kontrolü için infüzyonun başlamasından önce ve infüzyon başladıktan 4 saat sonra asetaminofen verilmelidir. İnfüzyon başladıktan sonraki ilk saat içinde her 15 dakikada bir, daha sonra infüzyon tamamlanıncaya kadar saatte bir vital belirtiler ölçülmelidir. Hematolojik yan etkilerin şiddetlenmesini önlemek için tedavi süresince AZA ve MMF kesilebilir. Siklosporin ve takrolimus ya tamamen kesilebilir ya da düşük-dozda uygulamaya devam edilebilir. Premedikasyonda metil-prednisolon verildiği için ağız yolundan verilen prednison kesilmelidir.
Poliklonal kaynaklı antikorların yan etkileri olarak üşüme-titreme, ateş yükselmesi (%80) ve eklem ağrıları sık görülmektedir. CMV infeksiyonu ve anaflaksi seyrek olmakla birlikte görülebilir. İlaç dozunun düşürülmesini gerektiren trombositopeni ve lökopeni oluşabilir. Timoglobulin uygulamasında lökopeni daha sık görülmekte ve hastaların yarısında ortaya çıkmaktadır. Trombosit sayısı 50-100 000 hücre/ml veya lökosit sayısı 3 000 hücre/ml nin altına düştüğü zaman, ilaç dozu genellikle yarıya indirilmektedir. Bu değerler daha da düştüğü zaman ilaç uygulaması durdurulmaktadır.
Muromonab-CD3:
Muromonab fare monoklonal antikoru olup T hücreleri ve medüller timositlerde eksprese edilen TCR/CD3 kompleksine spesifik etki gösterir. T hücrelerindeki CD3 kompleksine etki ederek immunsüpresif etki gösterirler. İlacın infüzyonundan sonra dakikalar içinde dolaşımdaki lenfositler temizlenir. Bu ilacı kullanan pek çok hastada ciddi yan etki olarak sitokin salınım reaksiyonu olabilir. Karaciğer nakli hastalarında muromonab-CD3 ile profilaksi yapılması standart CNİ bazlı tedavilere göre avantaj sağlamamıştır. Ancak karaciğer nakli sonrası dirençli rejeksiyon tedavisinde etkili bir ajan olarak kullanılmaktadır.
Monoklonal Anti-CD25 Antikor (Basiliksimab):
Humanize Anti-Tac (HAT) monoklonal antikor olan basiliksimab sıçan antikoru olarak üretilmekte ve daha sonra genetik mühendisliği yöntemleri ile bileşiğin büyük kısmı, insan IgG molekülü ile değiştirilmektedir. Basiliksimab IL-2 reseptörünün alfa zincirini (CD 25) hedef almakta ve antikorun reseptörlere bağlanması ile IL-2 aracılığındaki yanıtlar kilitlenmektedir. Dolayısı ile lenfosit aktivasyonunu inhibe etmektedir. Bu antikorlar, akut rejeksiyon ataklarını tedavi etmek için değil akut rejeksiyon riskini azaltmak için tasarlanmışlardır. Periferik kandaki yarı-ömürleri uzundur ve ilk-doz reaksiyonuna sebep olmazlar. Anaflaksi ve ilk-doz reaksiyonuna sebep olmamaları, büyük oranda insan kaynaklı olmaları ile açıklanmaktadır. Oportunistik infeksiyonlar (viral, bakteriyel) malignite ve posttransplant lenfoproliferatif hastalıklar (PTLD) nadir de olsa görülen yan etkileridir.
Karaciğer naklinde yaygın olarak kullanılan ilaç için önerilen doz ilki reperfüzyonun ilk 6 saati içinde, diğeri ameliyatın 4. gününde olmak üzere 2 doz şeklinde IV olarak yapılan 20 mg’dır. Bu uygulama, IL-2 alfa reseptör bölgelerinin 30-45 gün süre ile doymuş kalmasını sağlamaktadır (A5). Genellikle pahalı olduğu için rutin kullanılan ilaçlar değildir. Pediyatrik nakil hastalarında ve CNİ tedavi geciktirmesinin avantaj sağladığı böbrek fonksiyon bozukluğu olan hastalarda kullanımı önerilmektedir.
Monoklonal Anti-CD52 Antikor (Alemtuzumab):
Humanize anti-CD52 antikorları lenfositler, makrofajlar, natural killer hücreleri ile periferik lenf nodu ve dolaşımdaki timositleri selektif etkiler. Plazma hücreleri ile memori lenfositleri etkilemez. Alemtuzumab rejeksiyonun toplam insidansında artışa neden olmaksızın böbrek toksisitesini azaltmak için CNİ’den kaçınmak için kullanılabilir. Memori lenfositlerin varlığını sürdürmesi teorik olarak infeksiyon oranlarını azaltabilir ve bununda HCV reinfeksiyon oranlarını azalttığı düşünülmektedir. Bununla birlikte pratikte alemtuzumab indüksiyon tedavisi alan HCV negatif hastaların daha az akut rejeksiyon ve böbrek yetmezliği oranları ile daha iyi hasta ve graft sağkalımı sağladığı bilinmektedir. HCV infekte hastalarda virüs rekürrensi ile hala hastalık nüksü gelişebilmektedir.
T-Hücre Ko- stimülasyon blokörü (Belatecept):
Belatecept antijen presente eden hücre yüzeyindeki CD80 ve CD86’ya bağlanarak bunların T lenfosit yüzeyindeki CD28 ile interaksiyonunu ve sonuçta T lenfosit aktivasyonunu inhibe eden, ayrıca aktive hücrelerde apopitozise neden olan selektif kositümülasyon blokeri bir immunsüpresandır. FDA tarafından böbrek naklinde onaylanan belatecept renal fonksiyonları korumakta ve graft sağkalım süresini uzatmaktadır. Mikofenolik asid türevleriyle kombinasyonunda oldukça olumlu sonuçlar alınmaktadır. CNİ’süz protokol olanağı sağlamak suretiyle; CNİ’lerine bağlı akut ve kronik nefrotoksisiteyi engellemektedir. Siklosporin ile yapılan karşılaştırmalı çalışmalarda graft fonksiyonlarının daha iyi korunduğu, kardiyovasküler ve metabolik parametrelerin daha iyi olduğu gösterilmiştir. Ayrıca akut rejeksiyonu kuvvetli bir şekilde önlediği gösterilmiştir. Siklosporin ile yapılan 5 yıllık karşılaştırmalı diğer bir çalışmada; glomerüler filtrasyon hızının korunduğu, hasta/graft kaybı ve rejeksiyon oranının daha düşük ve gastrointestinal yan etki sıklığının daha fazla olduğu görülmüştür. Belateceptin ayda bir kez uygulama ve böbreğe daha az toksik yan etki avantajı vardır. Bununla birlikte aşırı immunsüpresyon nedeni ile viral ve fungal infeksiyonlar ile birlikte PTLD insidansında artış görülebilmektedir.
Monoklonal Anti-CD20 Antikor (Rituximab):
Organ naklinde kullanılan çoğu immunsüpresif ilaç T hücrelerini hedef alır. Ancak antikor ilişkili rejeksiyon ve donör spesifik antikorlar (ki ikisi de hem akut hem de kronik rejeksiyona neden olur) gibi B hücre ilişkili immun yanıtlarda olabilmektedir. Bu düşünce B hücrelerini hedef alan immunsüpresif ilaçların kullanılması ihtiyacını doğurmuştur. Rituximab matür ve prematür B hücrelerinde bulunan CD20 moleküllerine karşı geliştirilen monoklonal bir antikordur. Başlangıçta non-hodgkin lenfomanın tedavisinde kullanılmıştır. Organ naklinde ise ABO uyumsuz nakillerin tedavisinde, B hücre antikorları ile ilişkili rejeksiyonların tedavisinde ve alloreaktif antikor düzeylerini azaltmak için aşırı duyarlı hastalarda kullanılabilir. Antikor üreten plazma hücreleri CD20’yi eksprese etmediği için rituksimab direk olarak antikor yapımını etkilemez.
Yeni İmmunsüpresif İlaçlar
İmmunsüpresif tedavi olanaklarını geliştirmek ve genişletmek için geliştirilen ilaçların bazıları gündemden düşerken (Brequinar sodyum, siklosporin-G, Leflunomide, Deoksipergualin ve anti-adezyon molekül antikorları gibi) bazılarının (FTY 720 ve yeni antikor preparatları gibi) üzerindeki engellere karşı çalışmaları devam etmektedir. Bunlardan halen kullanımda olan bazıları daha az yan etki ve daha iyi tedavi indeksi sağlamak üzere geliştirilmeye çalışılırken, diğeri klinik çalışmalarda başarılı sonuçlara ulaşırsa yakın gelecekte, immunsüpresif tedavi uygulamasını radikal olarak değiştirebilecek niteliktedir. Bu ilaçlardan bazılarının isimleri; Efalizumab, Alefacept, TOL101, Eculizumab, Epratuzumab, Bortezomib, Voclosporin, Tasocitinib (CP-690550) ve Sotrastaurin (AEB-071) dir.
SDZ RAD
Sirolimusun bir türevidir. RAD molekülünün 40 pozisyonundaki hidroksietil zinciri, ilacı daha polar hale getirerek oral biyoyararlanımı artırmaktadır. RAD ile siklosporin birlikte kullanılabildiği halde, sirolimus ile siklosporin uygulaması arasında genellikle birkaç saatlik süre bulunması önerilmektedir. RAD’ın yarı-ömrü, sirolimustan kısadır. Bu ilacı, MMF, prednizon ve siklosporinden oluşan standart tedavi uygulaması ile kıyaslayan Faz III çalışmaları sürmektedir. ERLO80A, MMF’in, rahatsız edici yan etkileri daha az ve daha düşük dozlarda kullanıma olanak veren ve bağırsakta açılmak üzere kaplanmış şeklidir. Takrolimusla ilgili olan İndolil-ASC, daha iyi tedavi indeksine sahip olabilir.
FTY 720
Etki mekanizması daha öncekilerden farklı bir immün baskılayıcıdır. Bu ilaç periferik kanda T ve B hücre sayısını azaltırken, lenf nodlarında ve peyer plaklarında artırmaktadır. FTY 720’nin lenfositler üzerindeki kemokin reseptörlerini değiştirerek, yeniden yönlendirilmiş hücre yuvalanmasına yol açtığı düşünülmektedir. Sonuç olarak lenfositlerin graft infiltrasyonu baskılanmakta ve uzun süreli lenfopeni oluşmaktadır. FTY 720 uygulamasında immün hafıza bozulmamakta, granulosit işlevleri etkilenmemektedir. İlaç, siklosporinin immün baskılayıcı etkilerini güçlendirebilir. Bu konuda, Faz II çalışmaları sürmektedir.
FK 778
FK 778, A77 1726’den elde edilen sentetik malononitrilamid (MNA) olup leflunomidin aktif bir metabolitidir. FK 778, T ve B hücrelerindeki de-nova tirozin kinaz aktivitesini inhibe eder. Standart immunsüpresyon ilaçlarla birlikte kombine edildiğinde deneysel böbrek transplant modellerinde graft sağkalımını arttırmıştır.
Karaciğer Naklinde İmmunsüpresyon
Karaciğer nakli sonrası sağkalımdaki düzelme operatif ve perioperatif bakımdaki düzelmelerin yanında daha selektif ve daha az toksik immunsupresyonların kullanımına da bağlıdır. Organ nakli sonrası akut rejeksiyon oranı %25-80 arasında değişirken, beklenen kronik rejeksiyon oranı %5-10 kadardır. Karaciğer naklinde immunsüpresyon başlangıç (indüksiyon), idame ve rejeksiyon tedavisi olarak üç başlık altında toplanır. İndüksiyon tedavisi karaciğer graftının implantasyon ve reperfüzyon anında yüksek doz uygulanan immunsüpresyon aşamasıdır. Bu aşamada graftı akut hücresel rejeksiyondan korumak için yüksek doz kortikosteroid ve CNİ kombinasyonları tercih edilmektedir.
Kısa bir süre için uygulanan indüksiyon aşamasından idame tedavisine aşamalı bir şekilde geçilir ve graft fonksiyonel olduğu sürece devam edilir. Bu tedavi sürecinde genellikle CNİ’leri diğer grup ilaçlarla ikili veya üçlü kombinasyon yapılarak kullanılır. Tercih edilen ilaçların hedef çentik düzeyleri, hangi ilaçların kombine edileceği hastaların posttransplant süresine, rejeksiyon öyküsüne, altta yatan karaciğer hastalığına ve hastanın özelliklerine göre değiştirilebilir.
Karaciğer nakli sonrası hiperakut, akut hücresel ve kronik rejeksiyon olarak adlandırılan 3 tip rejeksiyon görülür. Bu aşamalarda tedavi edilen hiperakut veya antikor ilişkili rejeksiyon tedavisi en zor olanıdır ve genellikle yüksek mortalite ile ilişkilidir. Akut hücresel rejeksiyon tedavisinde yüksek doz kortikosteroid (yüksek bolus dozunda veya taper edilerek yapılan pulse tedavisi) uygulanabilir. Düşük ve orta dereceli rejeksiyon ataklarında steroid yeterli olurken, ciddi veya steroide dirençli rejeksiyon ataklarında poliklonal antikorlar kullanılabilir. Kronik rejeksiyonun tedavisi ise oldukça sınırlıdır.
Karaciğer nakli sonrası uzun dönem sonuçlar karaciğer hastalığının primer etyolojisi ile yakından ilişkilidir. Hastalık nüksü bu sonuçları büyük oranda etkiler ve bu durumda immunsüpresif rejimler önemli olabilir. Otoimmun hepatit, primer sklerozan kolanjit ve primer biliyer siroz gibi otoimmun karaciğer hastalıklarında yaklaşık %10-50 oranında hastalık nüksü veya sık rejeksiyon atakları gelişebilir. ABD’de primer sklerozan kolanjit karaciğer nakli yapılan hastaların %5’ini oluşturmaktadır. Sağkalımı yüksektir ancak nakil sonrası ilk 6 ayda özelliklede immunsüpresyonu düşük tutulan ve ciddi veya tedavi edilmemiş akut rejeksiyonu olan hastalarda %15 hastalık nüksü, %13 oranında da kronik rejeksiyon gelişebilir. Primer bilier siroz nakil sonrası %50 gibi rekürrens oranına sahip diğer bir kronik kolestatik karaciğer hastalığıdır. Ayrıca bu hasta grubunda rejeksiyon oranları da daha yüksektir. Tartışmalı olsa da takrolimuslu rejimlerde primer bilier siroz nüks oranı yüksek olduğu için siklosporin kullanılması tercih edilebilir. Steroid tedavisi rekürrens hastalığı önleyip tedavi edebilir. Ancak bazı otörler steroidlerin erken doz azaltılmasını tartışmalı bulmaktadır. Otoimmun hepatitli hastalarda da rekürrens oranı %33-50’nin üzerindedir. Bundan dolayı uzun dönem steroid içerikli agresif immunsüpresif rejimler rekürrensi önlemek için standart olarak kullanılmalıdır. Otoimmun hepatit nüksünün önlenmesinde takrolimusun siklosporine üstünlüğü net olarak kanıtlanamamıştır.
Yine fulminan karaciğer yetmezliği ve retransplant hastaları akut hücresel rejeksiyon açısından yüksek risklidir. Dolayısı ile bu grup hastalarda primer immunsüpresyon olarak takrolimus daha etkin olduğu için siklosporine tercih edilmelidir.
Hepatit B ile ilgili posttransplant sonuçlar etkili antiviral tedavilerin başarısı nedeniyle günümüzde düzelmiştir. İmmunsüpresyonun etkisi sınırlıdır ancak yinede zararlı etkilerinden dolayı steroidlerden kaçınmalı, mümkün olan en az düzey immunsüpresyon rejimleri tercih edilmelidir. Hepatit C hastaları ise immunsüpresyona oldukça duyarlıdır. Çünkü nakil sonrası yaklaşık 3. ayda HCV rekürrensi gelişerek, fibrozis süreci başlayabilmektedir. Bu rekürrensteki immunsüpresyonun etkileri tam olarak bilinmemekle beraber aşırı immunsüpresyonun katkı yaptığına inanılmaktadır. Bolus tarzında steroidlerin kullanımının HCV viremisini arttırdığı gösterilmiştir. Bu nedenle hafif rejeksiyon ataklarında steroid bolusu vermek yerine, hastanın kullandığı ilaç dozlarının arttırılması gerektiği savunulmaktadır. Buna ek olarak steroidsiz protokollerin fark yaratmadığı kabul edilmektedir. Siklosporinin HCV’ de in vitro olarak antiviral etkilerinin olduğu gösterilmiştir. Ancak pratikte siklosporinin takrolimusa üstün olup olmadığını araştıran yayınlarda ve meta analizlerde bu hipotez doğrulanamamıştır.
HCC’li hastalar kendi kanser öyküsü olması ve immunsüpresif ilaç kullanması nedeniyle malignite açısından özellikle risk altındadır. Preoperatif uygun hasta seçimi ve doğru immunsüpresif rejimler ile bu grup hastada 5 yıllık rekürrenssiz sağkalım oranı %80’nin üzerindedir. Her iki CNİ’nün yüksek plazma düzeyleri yüksek HCC rekürrens oranları ile ilişkilidir. Çünkü CNİ’leri in vitro olarak artmış anjiogenezis ve kanser hücresi invazyonu ile tümör büyümesini hızlandırdığı gösterilmiştir. Diğer yandan mTOR inhibitörleri karsinogenez ve kanser progresyonu ihhibisyonu ile anti tümör özelliğe sahiptir. mTOR inhibitörleri ile birlikte HCC rekürrens oranı %20’nin altındadır. Bu nedenle HCC’li hastalarda CNI azaltılması tavsiye edilmektedir. Diğer yandan retrospektif birçok klinik çalışma HCC’li hastalarda mTOR inhibitörlerinin (sirolimus/everolimus) kullanımı veya posttransplant switch edilmesini önermektedir. Ancak yine de HCC rekürrensinin mTOR inhibitörleri ile geciktirildiğine dair prospektif veriler bulunmamaktadır. Bununla birlikte mTOR inhibitörlerinin karaciğer nakli sonrası graft rejeksiyonu önlenmesinde uygun bulunmamakta ve mTOR bazlı immunsüpresyona değişim ile ilgili net bir zamanlamada ortak bir uzlaşma yoktur.
Sonuç olarak: karaciğer nakli alıcılarında immunsüpresyon güncel stratejisi; hastanın yaşı, cinsiyeti, etnik kökeni, altta yatan hastalık gibi demografik özelliklerin yanında, böbrek yetmezliği durumu, kardiyovasküler ve metabolik komplikasyonlar ile malignite gibi risk faktörlerini azaltmak için kişiye özel (houte couture) ilaç protokollerinin dizayn edilmesi şeklindedir.
